- Zip - 1.1 kio
Activité numérique : Ingestion de l’aspirine
Introduction :
Après ingestion, l’aspirine se retrouve dans l’estomac, un milieu aqueux très acide de pH voisin de 2. Pour atteindre sa cible, l’aspirine doit passer dans la circulation sanguine, un milieu aqueux. Pour cela l’aspirine doit traverser les parois lipidiques de l’estomac ou de l’intestin. Si l’aspirine est dissoute dans l’estomac, cette traversée est très limitée. Inversement, si la taille des cristaux d’aspirine est grande, ils traversent les parois lipidiques, mais ils ne se dissolvent que très lentement dans le sang. Dans l’intestin le pH passe à 8.
On cherche à savoir sous quelle forme se trouve l’aspirine dans l’estomac et dans l’intestin.
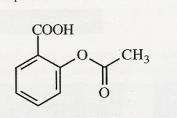
Document 1 : Formule de la forme acide de l’aspirine.
Document 2 : Tracer un graphique avec python
Si listeX et listeY sont des listes contenant respectivement toutes les valeurs à placer en abscisse et toutes les valeurs à placer en ordonnée.
- Pour tracer le graphique avec une ligne rouges, on écrit :
plt.plot(listeX,listeY, color=’red’,label=’legende de la courbe’ )
- Pour ajouter des titres, on peut écrire avant plt.show()
- Pour le titre général
plt.title(‘titre’)
- Pour les titres des axes :
plt.xlabel(’titre de l’axe des abscisses’)
plt.ylabel(’Titre de l’axe des ordonnées’)
- Pour la légende
plt.legend(loc=’best’)
- à mettre à la fin
plt.show()
Questions :
ANA
– 1 Ecrire la formule de la base conjuguée de l’aspirine.
– 2 Si on note AH, la forme acide de l’aspirine, écrire le tableau d’avancement la réaction de l’aspirine sur l’eau.
On cherche à représenter le pourcentage d’acide et de base en fonction du pH. Pour cela il faut exprimer la concentration en acide et en base en fonction du pH.
– 3 A l’aide du tableau d’avancement quel est le lien entre la concentration en base et le pH ?
– 4 A l’aide de l’expression du KA, en déduire la formule permettant de calculer la concentration en acide en fonction du pH et du KA ?
REA
– 5 Compléter la boucle permettant de calculer les concentrations en base et en acide pour chaque valeur du pH.
– 6 D’après le programme, quelle formule nous permet de calculer le pourcentage en une espèce donnée pour un pH ?
– 7 En s’inspirant du document 2, écrire les lignes permettant de tracer sur le même graphique les courbes des pourcentages massiques en fonction du pH.
VAL
Lancer le programme, après vérification l’imprimer.
– 8 Pour quel pH, y a-t-il autant d’acide que de base ?
– 9 Répondre au problème posé en introduction.
Article proposé par : Vanessa Yequel
Documents joints
Les programmes Python à compléter et corrigé Le document Word - Word - 64.1 kio
